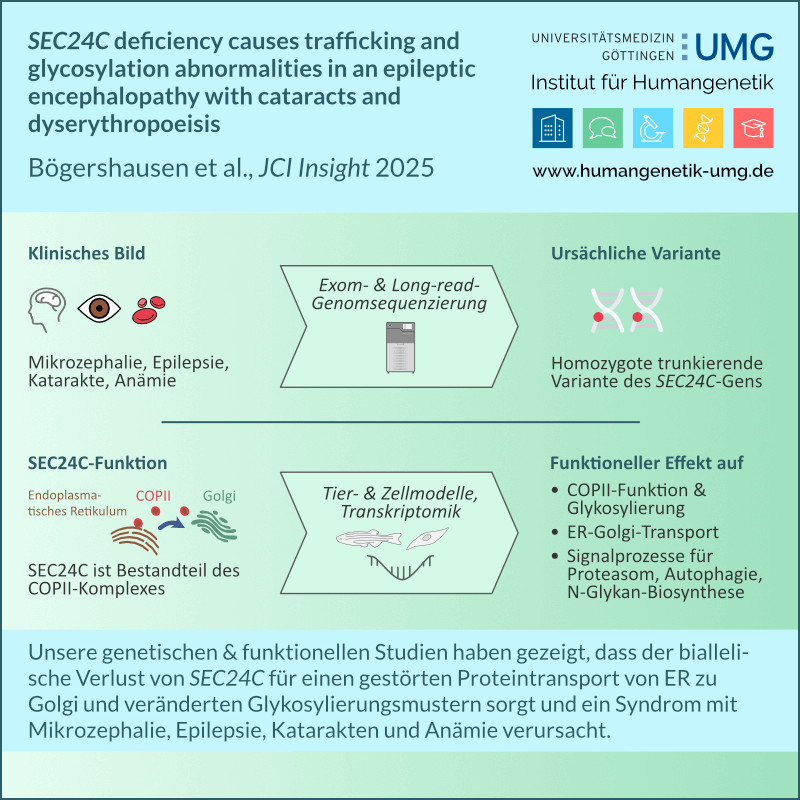
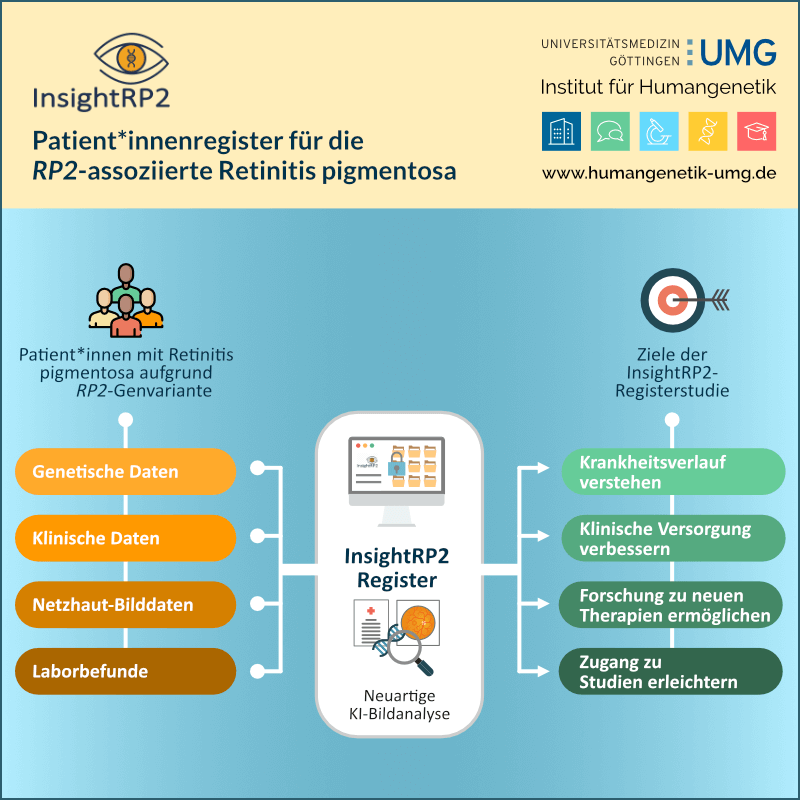
Gemeinsam Genomik neu denken – Das Modellvorhaben Genomsequenzierung an der Universitätsmedizin Göttingen
Das Institut für Humangenetik der Universitätsmedizin Göttingen nimmt am bundesweiten Modellvorhaben zur Genomsequenzierung teil, das vom Bundesministerium für Gesundheit (BMG) initiiert wurde. Ziel ist es, moderne DNA-Sequenziertechnologien gezielt in die Patientenversorgung zu integrieren und damit Diagnostik und Therapie insbesondere bei seltenen Erkrankungen und onkologischen Erkrankungen entscheidend zu verbessern.
Ein vom Biotechnologie-Unternehmen Illumina produziertes Video beleuchtet, wie an der UMG die Institute für Humangenetik und Pathologie im Bereich der Genomik, genetischen Diagnostik und speziell im Modellvorhaben zusammenarbeiten, um die Genomsequenzierung optimal zu nutzen und durch automatisierte Analysen und mittels künstlicher Intelligenz neue Krankheitsursachen zu entdecken, die Diagnostik zu verbessern und die Patientenversorgung auf ein neues Niveau zu heben.
Hintergrund des Modellvorhabens Genomsequenzierung
Im Rahmen der Nationalen Strategie für Genommedizin ermöglicht das Modellvorhaben nach § 64e SGB V erstmals, dass Patient*innen mit seltenen Erkrankungen oder onkologischen Erkrankungen nach positivem Entscheid durch eine lokale, interdisziplinäre Fallkonferenz umfassend genetisch untersucht werden können. Kernstück der modernen Genommedizin ist die Genomsequenzierung, mit der das gesamte Erbgut eines Menschen schnell, kosteneffizient und präzise sequenziert werden kann. Durch die Analyse der gewonnenen Daten lassen sich genetische Varianten identifizieren, die für bestimmte Erkrankungen verantwortlich sind. Dies erlaubt eine präzisere Diagnose sowie individuell zugeschnittene Behandlungsansätze.
Aktuell nehmen ausgewählte Spitzenzentren der Universitätsklinika in Deutschland teil, die über besondere Expertise und Erfahrung in der Genomdiagnostik verfügen.
Gemeinsam für die Zukunft der Genommedizin
Im Video betonen Prof. Bernd Wollnik, Direktor des Instituts für Humangenetik, und Prof. Philipp Ströbel, Direktor des Instituts für Pathologie, die dynamische Entwicklung ihrer Fachbereiche in Göttingen und den Erfolg ihrer Zusammenarbeit. „Das Modellvorhaben leitet wirklich eine neue Ära in Deutschland in der Genomik ein, weil wir auf einmal das Ganze in die Patientenversorgung bringen – das war vorher nicht möglich. Das sind Meilensteine für uns“, so Prof. Wollnik. Auch Prof. Ströbel unterstreicht die Bedeutung der Technologie für den klinischen Alltag: „Die Rolle von Next Generation Sequencing in der klinischen Diagnostik kann gar nicht hoch genug eingeschätzt werden. In meiner beruflichen Erfahrung war das mit Abstand die größte Veränderung, die den größten Fortschritt gebracht hat.“
Sie können auf Youtube und über LinkedIn das Video über die Arbeit unseres Instituts im Rahmen des Modellvorhabens ansehen: